近日,胰腺中心陈汝福课题组在胰腺癌神经浸润及转移的表观遗传调控研究领域中取得进展性突破,系列研究成果分别成果发表于国际著名期刊《Cancer Research》(影响因子:16.6)、《Molecular Cancer》(影响因子:33.9)、《Theranostics》(影响因子:13.3),系统阐明了肿瘤微环境中代谢重编程介导肿瘤细胞中表观遗传调控,进而促进胰腺癌转移的关键分子机理,为胰腺癌治疗提供潜在策略。
破解胰腺癌侵袭性生长的关键环节
胰腺被称为“癌中之王”,患者5年生存率不足10%。神经浸润是胰腺癌的显著生物学特征之一,超过80%的胰腺癌患者存在不同程度的神经浸润(癌细胞沿着神经扩散),直接导致术后复发率高及预后极差。然而,驱动神经浸润的肿瘤微环境调控机制尚未被完全阐明。
聚焦这一关键临床问题,陈汝福教授团队在《Cancer Research》上在线发表了题为“Cancer-Associated Fibroblasts Foster a High-Lactate Microenvironment to Drive Perineural Invasion in Pancreatic Cancer”的原创性研究论文,揭示了肿瘤相关成纤维细胞(CAFs)通过乳酸代谢重编程,促进胰腺癌神经浸润的关键分子机制。我院为全文第一完成单位,胰腺中心李婷婷博士、胡崇辉博士、黄天浩博士、周雨教授为共同第一作者,陈汝福教授、郑上游教授为共同通讯作者。

在本研究中,研究人员首次发现了在发生神经浸润的胰腺癌组织中存在一群特殊的CAFs细胞,并将其命名为pCAFs。通过小鼠模型证实,相比其他CAFs,其能更有效地促进肿瘤细胞向神经组织的定向侵袭。进一步深入研究发现,pCAFs通过乳酸代谢重编程向肿瘤微环境释放大量乳酸。这些乳酸被肿瘤细胞摄取后,通过调控组蛋白的表观遗传修饰,激活了与神经浸润密切相关的多个基因表达,从而加速了神经新生与肿瘤细胞的轴突导向侵袭过程。
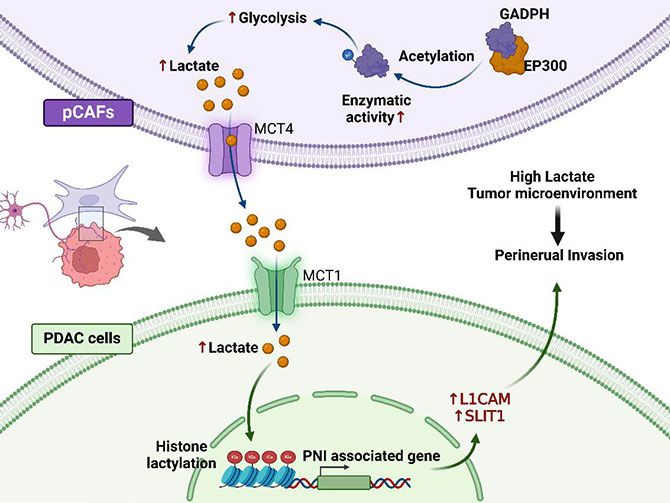
这项研究首次揭示了肿瘤微环境高乳酸微环境形成的原因,以及其驱动胰腺癌表观遗传改变进而促进神经浸润的关键机制,为基于包括乳酸化修饰在内的表观遗传调控,开发胰腺癌精准干预策略提供了新的理论依据与可行路径。
系列研究推动胰腺癌表观遗传研究转化平台搭建
为了进一步开发针对胰腺癌表观遗传调控网络的分子治疗靶点及小分子治疗手段,陈汝福教授团队对胰腺癌中的关键表观遗传分子进行了筛选,鉴定了胰腺癌特异性表达的circRNA及NamiRNA分子群,阐明其介导胰腺癌转移的关键机制。基于上述发现,研究团队初步构建了两种具有组织靶向性的脂质纳米颗粒(LNP)核酸递送系统,并在小鼠上实现了对胰腺癌的靶向抑制,成果相继在《Molecular Cancer》、《Theranostics》等杂志发表。
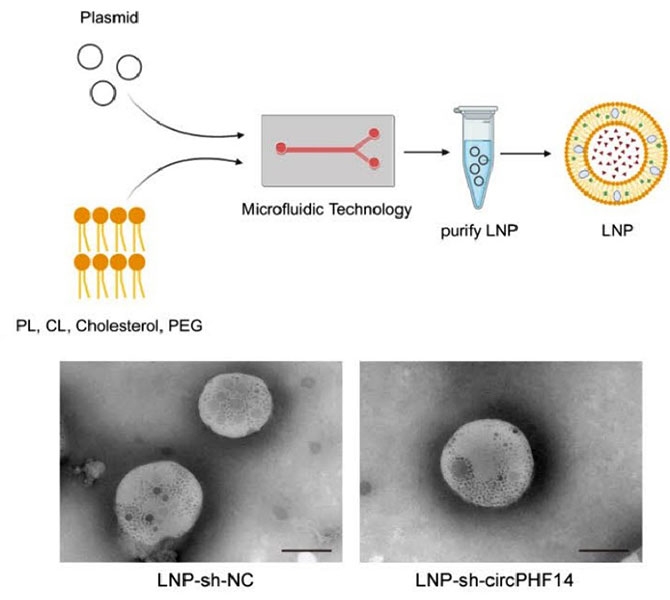
这些系列研究阐明了胰腺癌中表观遗传的多维度调控网络,并初步建立具有临床转化前景的小分子核酸药物靶向递送平台。目前,团队已开展多项胰腺癌的临床前及临床研究,为胰腺癌患者提供了新的治疗选择。该系列研究实现了从基础探索到临床转化的完整跨越,为胰腺癌的精准治疗开辟了新的方向。
罗宇明


