肝脏是主要的生酮器官,而酮主要在外周组织中通过关键酶OXCT1代谢。之前发现,在肝细胞癌(HCC)细胞中,酮解作用通过OXCT1的表达被重新激活,从而促进肿瘤进展;然而,OXCT1是否调控抗肿瘤免疫尚不清楚。
2024年5月15日,广东省医学科学院/广东省人民医院廉哲雄及华南理工大学高平共同通讯在Journal of Hepatology(IF=26)在线发表题为“Targeting OXCT1-mediated ketone metabolism reprograms macrophages to promote antitumor immunity via CD8+ T cells in hepatocellular carcinoma”的研究论文,该研究表明靶向OXCT1介导的酮代谢重编程巨噬细胞通过CD8+ T细胞促进肝细胞癌的抗肿瘤免疫。该研究发现抑制肿瘤相关巨噬细胞中OXCT1的表达可以通过琥珀酸-H3K4me3-Arg1轴减少CD8+ T细胞的衰竭。最初,在稳态下,OXCT1在肝巨噬细胞中高表达,在TAMs中,OXCT的表达进一步升高。巨噬细胞的oxct177缺陷通过将TAMs重编程为抗肿瘤表型来抑制肿瘤生长,减少CD8+ T细胞耗竭并增加CD8+ T细胞的细胞毒性。
机制上,高OXCT1表达诱导TAMs中酮解副产物琥珀酸盐的积累,通过提高Arg1启动子中H3K4三甲基化(H3K4me3)水平来促进Arg1的转录。此外,OXCT1的抑制剂 Pimozide抑制Arg1的表达以及TAM 向肿瘤表型的极化,导致CD8+ T细胞耗竭减少,肿瘤生长减慢。最后,巨噬细胞中OXCT1的高表达与HCC患者的低生存率呈正相关。总之,研究结果表明,OXCT1在表观遗传学上抑制抗肿瘤免疫,这表明在TAMs中抑制OXCT1活性是治疗肝癌的有效途径。

肝脏是人体的主要代谢器官。3-Oxoacid CoA- 122 Transferase 1 (OXCT1)作为酮解的关键酶,在成人肝细胞中表达不足。而前期研究发现,在营养受限条件下,OXCT1在肝癌细胞中高表达,促进肝癌细胞的存活。作为一个特殊的器官,肝脏富含库普弗细胞和单核细胞来源的巨噬细胞。因此,程序化肿瘤相关巨噬细胞(programmed tumor-associated macrophages,TAMs)在HCC肿瘤微环境中的发育对肿瘤的发生和生长具有重要意义。Puchalska等人发现巨噬细胞优先利用酮类而不是葡萄糖产生能量。然而,OXCT1在肿瘤免疫微环境中的表达模式以及OXCT1在TAMs中的功能仍不清楚。
TAMs表达PD-L1和PD-L2,它们与CD8+ T细胞上的受体结合,导致CD8+ T细胞衰竭和凋亡。因此,TAMs通过促进肿瘤免疫逃逸来促进HCC的发生。促进巨噬细胞向TAMs极化的因素有很多,如细胞因子CSF、代谢酶PKM、代谢物乳酸、胆固醇和琥珀酸、缺氧微环境。巨噬细胞极化为TAMs驱动代谢重编程,包括增加脂肪酸氧化(FAO) 和线粒体氧化磷酸化(OXPHOS) 。阻断分化和促进TAMs重编程可抑制肿瘤生长。
抑制TCA和OXPHOS进程可降低TAMs中精氨酸酶1 (Arg1)的水平。高精氨酸酶在一些类型的癌症中,包括乳腺癌、非小细胞肺癌、肾癌和结直肠癌,都报道了这种水平。在肿瘤微环境中存在的精氨酸酶能够通过限制氨基酸的可用性来抑制免疫反应。精氨酸酶活性还导致MHC II类分子的表达下调,这些分子是抗原呈递所必需的。迄今为止,OXCT1和酮体代谢是否调节HCC中巨噬细胞的极化和精氨酸酶水平尚不清楚。
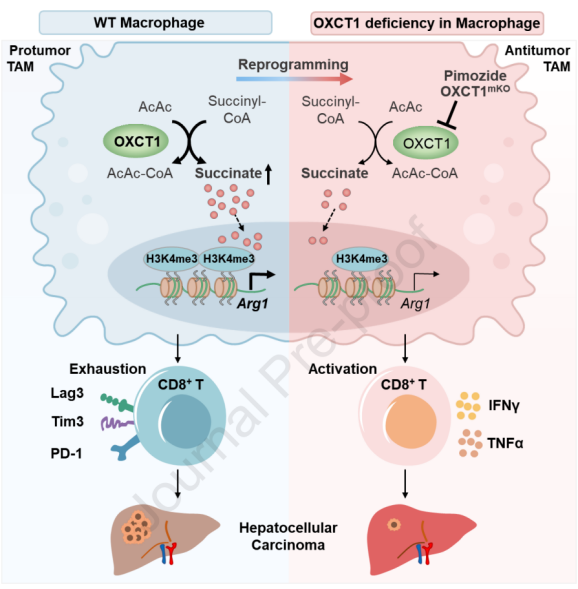
该研究强调了OXCT1在TAMs介导的免疫抑制及其对HCC进展的影响中的关键作用。通过阐明TAMs介导的免疫逃避的分子机制以及抑制OXCT1在TAMs中的潜在治疗益处,该研究为开发增强抗肿瘤免疫反应和改善HCC治疗结果的新策略提供了有价值的见解。总的来说,该研究发现TAMs中的OXCT1对HCC生长很重要,并且靶向TAMs中的OXCT1可能是HCC的潜在治疗方法。
原文链接:https://doi.org/10.1016/j.jhep.2024.05.007


