胰腺癌被称为“癌中之王”,是最具侵袭性、预后最差的实体恶性肿瘤之一。神经浸润(Perineural Invasion, PNI)是指癌细胞侵入和沿着神经周围的间隙和神经束膜扩散的过程,是胰腺癌最为独特的生物学特征,绝大部分胰腺癌组织中存在PNI,也是胰腺癌不良预后的关键因素。胰腺癌发生发展受肿瘤细胞内在和肿瘤微环境的共同调控,更好地了解胰腺癌肿瘤微环境与PNI的相互作用和机制,对发现新的生物诊断标志物和治疗靶点至关重要。
联合胰周神经清扫显著改善患者预后
针对胰腺癌容易侵犯神经,并沿着神经进行转移和复发的特点,广东省医学科学院副院长陈汝福教授在国内外率先提出胰周神经丛的完整清扫是降低术后复发的关键,从而建立并完善了“联合胰周神经清扫的胰头癌根治术”这一手术技术方式,使可切除胰头癌患者的无进展生存期延长22%,尤其术前CA19-9<200U/mL的患者无进展生存时间可延长73%。研究成果经国际同行评议后于2022年12月发表在SCI期刊《Cancer Communications》
靶向神经侵犯微环境为胰腺癌带来新的治疗靶点
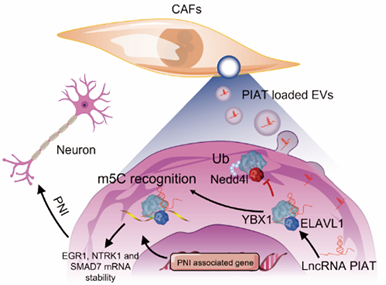
在此基础上,陈汝福教授团队深入探索胰腺癌神经浸润的潜在机制,以望为寻找干预、阻断胰腺癌神经浸润的药物靶点。近期,陈汝福教授团队在Science Translational Medicine上发表了Extracellular vesicle–packaged PIAT fromcancer-associated fibroblasts drives neuralremodeling by mediating m5Cmodification in pancreatic cancer mousemodels的文章。该研究结果阐明PDPN+ CAFs(Cancer-Associated Fibroblasts)通过外泌体递送非编码RNA PIAT片段至胰腺癌细胞调控YBX1依赖的m5C修饰,促进胰腺癌神经浸润的关键分子机制,有望为早期诊断及靶向胰腺癌神经浸润提供的新的靶点。

首先,研究人员利用超声内镜及多重免疫荧光解析不同神经浸润程度胰腺癌患者标本中肿瘤微环境肿瘤的特征,发现PDPN+ CAFs在严重神经浸润患者中显著富集。通过DRG、坐骨神经小鼠及KPC转基因小鼠模型证实PDPN+ CAFs可促进胰腺癌嗜神经生物学行为。进一步利用高通量测序筛选、蛋白芯片等手段发现,PDPN+ CAFs可通过外泌体递送非编码PIAT片段至肿瘤细胞,促进肿瘤细胞神经浸润;此外研究人员发现诱导后的肿瘤细胞可分泌TNF-α促进PDPN+ CAFs活化的正反馈环路。
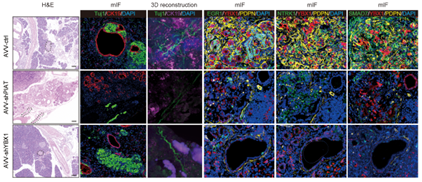
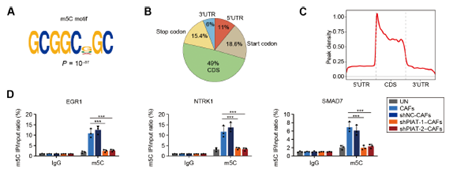
接着,研究人员深入探究PDPN+ CAFs促进胰腺癌神经浸润的分子机制,银染联合Co-IP、RIP-seq及m5C-seq等实验发现经外泌体递送至肿瘤细胞的PIAT直接结合m5c识别蛋白YBX1及ELAVL1,抑制YBX1泛素化降解,特异性增强YBX1与神经浸润关键基因的结合,进而以m5C修饰依赖途径增强神经浸润关键基因mRNA稳定性,促进胰腺癌神经浸润。
最后,研究人员评估了PDPN+ CAFs外泌体来源的PIAT丰度在胰腺癌预后预测中的价值。多中心研究结果提示发现血浆外泌体或组织中高PIAT表达与较短的总生存期和无病生存期相关,RCS曲线显示,血浆外泌体PIAT与总生存期和无进展生存期的危险比之间有更强的线性关系。ROC分析显示血浆外泌体PIAT的诊断准确性高于血浆CA19-9,用于预测胰腺癌患者中神经浸润的发生